《元素周期律》教学设计
佛山市南海区第一中学 谭德鸿
课题 | 元素周期律 | 课型 | 新授课 | |||||||||||||||||||||||||||||||||||||||
教材版本 | 人教版高中化学必修2 | 章节 | 第一章第二节 | |||||||||||||||||||||||||||||||||||||||
一.教材分析 | ||||||||||||||||||||||||||||||||||||||||||
本课题选自人教版高中化学《必修2》第一章第二节,元素周期律是元素周期表中蕴含的重要思想观念,揭示了元素性质存在的周期性变化规律,是高中化学学习的重要理论工具。 根据《普通高中化学课程标准(2017年版)》,本课题的内容要求如下: 1.了解原子核外电子排布,结合有关数据和实验事实,认识原子结构、元素性质呈现的周期性变化规律,构建元素周期律。 2.知道元素周期表的结构,以第三周期的钠、镁、铝、硅、磷、硫、氯以及碱金属和卤族元素为例,了解同周期和同主族的元素性质递变规律。 因此,本课题在高中化学学习中具有承上启下的作用,一方面可以促使学生对元素及其化合物的相关性质进行归纳与总结,理解不同元素之间的区别与联系,逐步形成“结构决定性质”的重要思想观念,从感性认识上升到理性认识,这是对《必修1》学习的承接。另一方面,可以帮助学生理解元素周期表中“位置—结构—性质”三者之间的关联,为今后学习能层能级、核外电子排布规律、电离能与电负性等知识奠定基础,也是对《选修3物质结构与性质》学习的铺垫。 | ||||||||||||||||||||||||||||||||||||||||||
二.学情分析 | ||||||||||||||||||||||||||||||||||||||||||
现阶段的学生在知识层面已经具有如下储备: 1.常见元素及其化合物的相关性质; 2.元素周期表结构与位置的相关意义; 3.碱金属元素和卤族元素的原子结构、元素性质递变规律。 而在能力层面已经具有如下水平: 1.初步了解“结构决定性质”的思想观念; 2.能够自主设计与完成常见金属的相关实验; 3.具有一定的信息接收与加工能力,对于数图分析、实验演绎、证据推理等学习方式具有浓厚兴趣。 因此现阶段的学生,适宜通过多角度与多方法,对元素周期律进行探究性学习。 | ||||||||||||||||||||||||||||||||||||||||||
三.化学核心素养分析 | ||||||||||||||||||||||||||||||||||||||||||
本课题由于兼有理论性与实验性,因此适宜开展各种教学活动,落实化学核心素养。
例如:化学历史的引入讲述可以培养科学精神与社会责任;数学图像的规律探究可以培养证据推理与模型认知;实验方案的设计实践可以培养实验探究与创新意识;实验成果的汇报交流可以培养宏观辨识与微观探析。当然,还有更多更好的新思路,值得我们不断探究与尝试。 | ||||||||||||||||||||||||||||||||||||||||||
四.教学目标 | ||||||||||||||||||||||||||||||||||||||||||
教学目标包括如下三个层面: 1.知识层面:认识原子结构、元素性质的周期性变化规律,形成“结构决定性质”的思想观念; 2.能力层面:理解元素周期表中“位置—结构—性质”三者之间的关联,能够分析、预测、比较元素及其化合物的相关性质; 3.精神层面:体会元素周期律在科学研究中的重要作用,引导学生热爱化学理论知识,享受化学探究过程。 | ||||||||||||||||||||||||||||||||||||||||||
五.教学思路 | ||||||||||||||||||||||||||||||||||||||||||
教学思路包括:课堂活动线、知识结构线、素养水平线,做到三线合一,相辅相成,实现教学目标。
在推进课堂活动的同时,不仅落实了元素周期律的相关知识点,还培养了学生多方面的化学核心素养。用“问题导学法”代替传统的“讲授归纳法”,使本节课最终能够呈现宏观、微观、符号、曲线的全面四重表征。 | ||||||||||||||||||||||||||||||||||||||||||
六.教学内容 | ||||||||||||||||||||||||||||||||||||||||||
教学环节 | 教师活动 | 学生活动 | 设计意图 | |||||||||||||||||||||||||||||||||||||||
化学趣闻 | ①讲述化学史上的趣闻:法国化学家德布瓦绍德朗发现了新元素镓以后,收到门捷列夫的来信,信中不仅指出了镓的密度数据有误,还准确预测了镓的很多性质,就是所谓的“类铝”。 | 聆听化学历史趣闻,联想门捷列夫与元素周期表的相关史实。 | 化学历史创设情景,激发学生学习兴趣,与最后的教学环节形成前后呼应的效果。 | |||||||||||||||||||||||||||||||||||||||
②提出问题:门捷列夫是依据什么能够做到未卜先知,甚至准确预测的呢? | 集体回答问题,知晓元素周期表内蕴含的重要思想观念——元素周期律。 | 引出本节课的探究对象——元素周期律。 | ||||||||||||||||||||||||||||||||||||||||
温故知新 | ①带领学生回顾所学知识:以碱金属和卤族元素为例,同主族从上到下,原子结构、得失电子能力、化学性质的递变规律。 | 集体回答问题,回顾复习所学知识,理解原子结构、得失电子能力、化学性质这三者之间的逻辑因果关系。 | 以学生现有的知识为载体,加深“结构决定性质”的思想观念,为后面分析同周期从左到右的变化规律奠定方法基础。 | |||||||||||||||||||||||||||||||||||||||
②提出问题:同周期从左到右,又会不会存在什么变化规律呢? | 加以思考,提出猜想。 | 由同主族变化规律延伸猜想同周期变化规律,达到温故而知新的效果。 | ||||||||||||||||||||||||||||||||||||||||
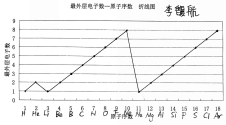
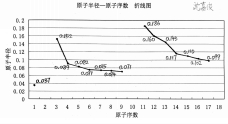
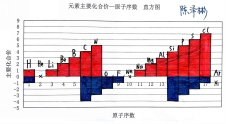
数图分析 | ①引导鼓励学生根据课前预习的成果:1~18号元素的相关折线图和直方图,进行课堂上的分享与交流。 | 课前预习时,已经根据课本第13-15页的相关数据,绘制了相应的图像。 | 运用数学手段,将书本的数据变化以曲线变化形式更加直观地表示出来,达到曲线表征的效果。 | |||||||||||||||||||||||||||||||||||||||
②提问学生:依据“最外层电子数—原子序数 折线图”,能够发现什么规律?并加以归纳总结。
| 个体回答,总结随着原子序数的递增,原子最外层电子数的周期性变化。 | 巧用数学手段,实现跨学科的能力迁移运用。 | ||||||||||||||||||||||||||||||||||||||||
③提问学生:依据“原子半径—原子序数 折线图”,能够发现什么规律?并加以归纳总结。
| 个体回答,总结随着原子序数的递增,原子半径的周期性变化。 | |||||||||||||||||||||||||||||||||||||||||
④提问学生:“原子半径的周期性变化” 与“核外电子排布的周期性变化”之间会不会有什么关联呢?并加以归纳总结。 | 个体回答,总结同周期情况下,原子核电荷数增加与原子半径减小的因果关系。 | 加深“结构决定性质”的思想观念。 | ||||||||||||||||||||||||||||||||||||||||
⑤提问学生:依据“元素主要化合价—原子序数 直方图”,能够发现什么规律?并加以归纳总结。
| 个体回答,总结随着原子序数的递增,元素主要化合价的周期性变化,以及数值上的相关规律。 | 巧用数学手段,实现跨学科的能力迁移运用。 | ||||||||||||||||||||||||||||||||||||||||
⑥归纳总结:随着原子序数递增,元素的原子结构确实存在周期性的变化,从左到右,最外层电子数逐渐增多,原子半径逐渐减小。 | 思考总结、消化理解、能力提升。 | 实现第一个探究任务的教学目的。 | ||||||||||||||||||||||||||||||||||||||||
⑦带领学生根据“结构决定性质”思路,进行推理猜想:同周期从左到右,金属性会逐渐减弱,非金属性会逐渐增强。 | 立足“结构决定性质”,进行理论推理,共同提出猜想。 | 为后面的实验演绎与证据推理等验证性教学环节做好铺垫。 | ||||||||||||||||||||||||||||||||||||||||
实验演绎 | ①引导学生进行Na、Mg、Al的实验方案设计与实践,验证同周期从左到右,金属性会逐渐减弱的猜想。 | 以小组形式进行实验方案的讨论设计,自主完成实验,记录实验现象,交流实验结论。 | 以实验演绎的方式去探究与理解元素周期律。 | |||||||||||||||||||||||||||||||||||||||
②提问学生:关于金属单质与水反应置换出氢气的难易程度的实验具体情况。引导学生结合所学知识,巧用丁达尔效应改进课本实验。
| 个体回答,关于反应条件与产生气泡速率的差异,以及滴加酚酞后红色深浅程度的差异。并且运用丁达尔效应检验Al与H2O反应的情况。说明金属性Na>Mg>Al。 | 锻炼学生的实验观察能力与总结汇报能力。通过自主实验不仅激发了学生的探究兴趣,感受化学研究的基本方法,还培养宏观辨识与微观探析、实验探究与创新意识的化学核心素养。 | ||||||||||||||||||||||||||||||||||||||||
③提问学生:关于金属单质与酸反应置换出氢气的难易程度的实验具体情况。 | 个体回答,关于反应条件与产生气泡速率的差异。说明金属性Na>Mg>Al。 | |||||||||||||||||||||||||||||||||||||||||
④提问学生:关于最高价氧化物的水化物——氢氧化物的碱性强弱的实验具体情况。
| 个体回答,关于滴加酚酞后红色深浅程度的差异,以及pH试纸与pH计的相关数据结果。说明金属性Na>Mg>Al。 | |||||||||||||||||||||||||||||||||||||||||
⑤提问学生:关于置换反应的实验具体情况与方案的合理性问题。 | 个体回答,解释Na与MgCl2溶液反应的真实本质,无法用于说明无法说明金属性Na>Mg。 | |||||||||||||||||||||||||||||||||||||||||
⑥归纳总结:同周期元素,从左到右,金属性确实是逐渐减弱的。 | 思考总结、消化理解、能力提升。 | 实现第二个探究任务的教学目的。 | ||||||||||||||||||||||||||||||||||||||||
证据推理 | ①引导学生根据阅读材料,进行Si、P、S、Cl的证据推理,验证同周期从左到右,非金属性会逐渐增强的猜想。 | 以小组形式进行讨论交流,完善推理过程。 | 以证据推理的方式去探究与理解元素周期律。 | |||||||||||||||||||||||||||||||||||||||
②提问学生:Si、P、S、Cl2分别与H2反应的条件能说明什么? | 个体回答,从卤族元素迁移可知,非金属性越强,非金属单质与H2反应就会越容易,反应也会越剧烈。从而推理出非金属性是Cl>S>P>Si。 | 强调类比学习与知识迁移的重要性,充分运用所学知识,解决陌生推理问题,从而培养证据推理与模型认知的化学核心素养。 | ||||||||||||||||||||||||||||||||||||||||
③提问学生:继续推理,Si、P、S、Cl的氢化物中,哪个最稳定? | 立足规律,非金属性越强,气态氢化物越稳定。从而推理出稳定性是HCl>H2S>PH3>SiH4。 | |||||||||||||||||||||||||||||||||||||||||
④提问学生:Si、P、S、Cl的最高价氧化物对应水化物的酸性强弱又能说明什么? | 个体回答,从卤族元素迁移可知,非金属性越强,最高价氧化物对应水化物酸性越强。再推理出非金属性是Cl>S>P>Si。 | |||||||||||||||||||||||||||||||||||||||||
⑤归纳总结:同周期元素,从左到右,非金属性确实是逐渐增强的。 | 思考总结、消化理解、能力提升。 | 实现第三个探究任务的教学目的。 | ||||||||||||||||||||||||||||||||||||||||
化学魅力 | 回顾元素周期律被发现与完善的艰辛历程,以及中国化学家们的卓越贡献,引导学生热爱化学理论知识,享受化学探究过程。 | 感受化学的魅力,激发内心的向往。 | 升华本节课的主题——科学精神与社会责任。 | |||||||||||||||||||||||||||||||||||||||
七.教学亮点 | ||||||||||||||||||||||||||||||||||||||||||
这样的教学设计,使本节课具有如下的教学亮点: 1.打破传统教学思路。化学历史创设情景,数学手段分析规律,自主实验验证假说,使本节课呈现多角度多方法的探究性学习方式。 2.强化实验创新能力。引导学生发散思维,充分运用所学知识,巧用丁达尔效应、pH试纸等方式对课本的相关实验进行完善。 3.巧设问题导学建构。学生兴趣得以激发,教学活动环环相扣,使学生在解决问题的过程中逐步建构起元素周期律。 4.追求多维素养目标。多元化的教学方式,启发性的师生互动,使课堂符合多种化学核心素养的要求。 | ||||||||||||||||||||||||||||||||||||||||||
八.板书设计 | ||||||||||||||||||||||||||||||||||||||||||
元素周期律 原子结构:原子半径、最外层电子数
得失电子能力
化学性质:化合价 金属性和非金属性 宏观实验事实 | ||||||||||||||||||||||||||||||||||||||||||