《溶液》复习课教学设计
广州市南国学校 郑晓明
【教学目标】
1.观察溶液的形成时发生的现象,了解溶解时的吸热或放热现象,初步理解溶液导电的原因,知道常见溶液中溶质的微观存在形式。
2.利用溶解度曲线上点与曲线位置的关系,理解饱和溶液与不饱和溶液的相互转化、结晶原理、溶解度等概念。并能比较不同状态下溶液中溶质的质量分数的大小。
3.运用已有知识分析问题,设计实验,培养学生独立思考能力。
4.以溶解度曲线为抓手,辨析众多概念,体验多角度解决问题的方法。
【教学重点】
点的移动与溶液转化的关系
【教学难点】
溶液微粒观、点的移动对溶液溶质质量分数的影响
【教学方法】
实验演示、问题引导探究
【教学用具】
电脑教学平台,实验药品(略),实验仪器(试管等)。
【教学过程】
教学 流程 | 教师活动 | 学生活动 | 设计意图 | ||||||||||||
创 设 情 景
复 习 溶 液 的 形 成 | 学习溶液后,同学们的学习热情高涨,有同学设计了几个有趣的实验,请同学上来演示实验,其他同学认真观察现象并思考。 〔板书〕 溶液 一、溶液的形成及微粒观
问:1.请同学表述现象。 2.请用所学知识分析原因。
| 三个学生演示实验:分别配制55g溶质的质量分数为9%的蔗糖溶液、氢氧化钠溶液、硝酸钾溶液(分别称量5.0g蔗糖、氢氧化钠、硝酸钾固体于100ml烧杯中,加50ml蒸馏水,搅拌),将所得溶液依次小心倒入事先准备好的瓶口放有鹌鹑蛋的烧瓶底部,观察现象。
学生观察分析并回答: 固体溶解,倾倒蔗糖溶液后,鹌鹑蛋无明显变化。倾倒氢氧化钠溶液后,鹌鹑蛋会缓慢上升,并从瓶口“吐”出来,倾倒硝酸铵溶液后,发现鹌鹑蛋被烧瓶“吞”进去。 | 依据探究目的设计并优化实验方案,完成实验操作,能对观察记录的信息加工并获得结论。 培育学生观察、辨识一定条件下常见的几种物质溶解时的现象。 把“学生参与”作为课堂基本策略。学生在参与中感知,在感知中收获,在收获中提升,同时把学生的学习热情调动起来。
| ||||||||||||
探究溶液里的微粒 | 追问:三种固体都溶解了,溶质在溶液中以什么形式存在?
有些溶液是可以导电的,所以湿手不能用电器开关等
| 一学生演示导电性实验,其他同学认真观察现象,分析原因,得出结论,填写学案。
| 能运用符号表征溶液中的微粒,从物质的微观层面理解溶液组成及导电原因。 具有严谨求实的科学态度,并把所学知识运用到生活中。 | ||||||||||||
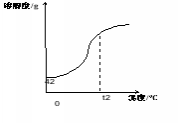
溶解度曲线 | 引入:判断上述氢氧化钠溶液是不是饱和溶液?
启发:除了实验的方法,能不能从理论上推导?给出溶解度表 氢氧化钠溶解度表
分析溶解度表的优缺点,由溶解度表的不足引入溶解度曲线,在学案上画出氢氧化钠溶解度曲线。 〔板书〕二、溶解度曲线
| 学生思考,提出判断方法:向里面继续加少量的氢氧化钠,如果能溶解就是不饱和溶液,如果不能溶解了,就是饱和溶液。 学生回顾表中“109”的含义,20°C100g水中溶解109g氢氧化钠达到饱和,那么50g水中溶解54.5g氢氧化钠才达到饱和,所以配制的氢氧化钠溶液是不饱和溶液。 领悟溶解度表的优缺点,在学案上画出氢氧化钠溶解度曲线
| 初步学会根据溶解度表和溶解度曲线收集各种证据,学习对数据的不同处理方法。深刻理解溶解度及溶解度曲线。
氢氧化钠溶解度曲线与书本中的溶解度曲线形状不一样,让学生相信自已,进一步形成化学自信。
| ||||||||||||
点的移动与溶液转化的关系
| 提出问题:同学配制的氢氧化钠溶液在溶解度曲线图上的对应位置在哪里?
〔板书〕三、点的移动与溶液转化关系
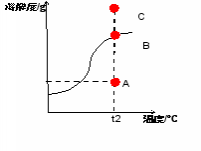
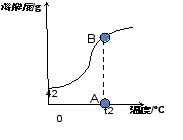
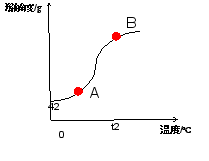
到底是哪个点呢?师生一起小心求证: (一)点与溶液状态的关系 如图,请问溶解度曲线上点与溶液状态的关系是怎样的? (二)点的移动与溶液转化关系 追问:1.A点溶液怎么转化为饱和溶液?
再引导:增加多少溶质呢?其他条件变不变?降低温度降到多少才变成饱和溶液?
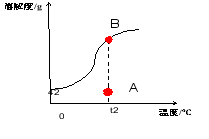
追问:2.A、B、C、D四点溶液中溶质的质量谁多谁少?
追问:3.找出同学配制的氢氧化钠溶液在溶解度曲线图上的对应位置。它怎么转化为饱和溶液?
老师强调答题时思维要严谨,实事求是,不死记知识点: 1.如A点溶液转化为B点饱和溶液时不能只说增加溶质,应是保持温度不变,增加溶质 2.不能死记答案,如本节课配制的氢氧化钠溶液就不能通过降低温度变成饱和溶液 3.诊断题中b点转化为c点不能只答增加溶剂,应答增加70°C的溶剂 | 学生大胆猜想并说出理论依据 首先,确定温度是20°C,但肯定不在曲线上及曲线上方。范围缩小到线段AB上。
学生思考并回答: 1.点在曲线上———溶液为饱和溶液。 2.点在曲线下方———溶液为不饱和溶液。 3.点在曲线上方———溶液为饱和溶液,且有未溶解的固体。
学生做小老师,到讲台上演讲,其他同学评价。 生一:有三种方法,一是增加溶质,二是降低温度,三是蒸发溶剂 大多数同学同意。
学生再思考。生二归纳:一是保持温度不变,增加(b-a)g溶质,二是降低温度到t1,三是蒸发溶剂
学生观察图,略作思考,回答: C=B>A=D
学生讨论:20°C,50g水中溶解了5g氢氧化钠,相当于100g水中溶解了10g氢氧化钠,所以那个点的坐标是(20,10) 它怎么转化为饱和溶液呢?学生边画图边归纳 生三:保持温度不变,增加溶质;蒸发溶剂;这时降低温度不能使它变成饱和溶液。
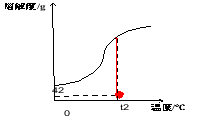
自我诊断: 图为KNO3的溶解度曲线,a、b在溶解度曲线上。
(4)欲使KNO3溶液的状态从b点转化为c点,可采取的措施是________________。
| 经历科学探究的一般过程,学会提出问题、分析推理、归纳总结、拓展知识。
知识梳理,突出内在联系。提炼解决问题的思维方法和步骤。
有梯度的问题设计和适时追问,将零落的知识串成线。
基于溶解度曲线上点的移动对溶液转化的关系进行分析推理,对物质的溶解和结晶的变化提出可能的假设,依据收集的证据与证实的结论建构模型,运用模型来描述和解释一些现象。
了解学生学习情况,及时反馈学习过程中的易错点、易混点,发展学生思维。 | ||||||||||||
点 的 移 动 对 溶 液 的 溶 质 质 量 分 数 的 影 响
| 我们还经常利用溶解度曲线计算溶液中溶质的质量分数。 〔板书〕四、点的移动对溶液的溶质质量分数的影响
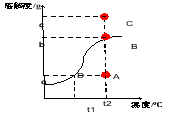
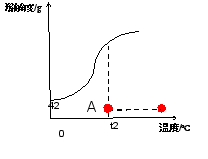
讨论下列问题,并小结规律: 1.向上述氢氧化钠溶液(5g氢氧化钠溶解在50ml蒸馏水中)继续加溶质氢氧化钠,A点怎么移动?溶液中溶质的质量分数怎么变?
引导学生小结:一定温度下,溶液达到饱和状态时,溶质的质量分数达到最大值,最大值为: 溶解度
100g+溶解度
2.加热上述氢氧化钠溶液(5g氢氧化钠溶解在50ml蒸馏水中) ,A点怎么移动?溶液中溶质的质量分数怎么变?
引导学生小结:升高温度,溶质和溶剂的质量不变,溶质的质量分数不变。
3.比较A、B二点溶液中溶质的质量分数谁大谁小?
4.分组计算:①20 ℃时,100g水中溶解109g氢氧化钠达到饱和时溶液中溶质的质量分数。 ② 20 ℃时,200g水中溶解218g氢氧化钠达到饱和时溶液中溶质的质量分数。 ③ 20 ℃时,300g水中溶解327g氢氧化钠达到饱和时溶液中溶质的质量分数。
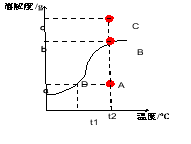
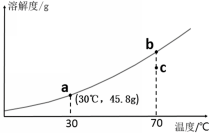
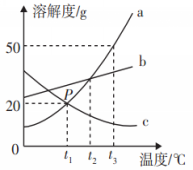
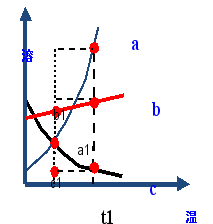
再上层楼:如果两条或三条曲线在温度改变后溶质质量分数的变化问题怎么分析呢? 例:如图是a、b、c三种物质的溶解度曲线。据图回答下列问题: t3°C时,将a、b、c三种物质的饱和溶液降温到t1°C,三种溶液中溶质的质量分数由大到小的顺序为_______。 | 小组合作完成,并展示。
组一:边画图边讲解
向上述氢氧化钠溶液(5g氢氧化钠溶解在50ml蒸馏水中)继续加溶质氢氧化钠,A点沿垂直于t2的直线向上移动,溶液中溶质的质量分数逐渐增大。当到B点时溶液中溶质的质量分数达到最大值。
组二:边画图边讲解 加热上述氢氧化钠溶液(5g氢氧化钠溶解在50ml蒸馏水中) ,A点平行向右移动,此时溶液中溶质、溶剂的质量都没变,所以溶液中溶质的质量分数不变。
组三:展示B>A 小结:溶解度随温度的升高而增大的物质,温度越高,溶质的质量分数也越大。
分组计算,归纳规律。 组四:展示计算结果,发现规律 小结:在相同温度下,同种溶质的饱和溶液,其溶质的质量分数相同。
课堂诊断: 1.图为KNO3的溶解度曲线,a、b在溶解度曲线上。
(3)将a点对应的溶液升温到70℃,其质量分数______。(填“变大”或“变小”或“不变”)
学生讨论,组五展示
降温到t1,实际上就是比较b1、a1、c1,所以三种溶液中溶质的质量分数由大到小的顺序为b>a>c
| 站在知识系统化整体化的高度,启迪学生的科学思维。让学生在讨论中学会与别人交流,增强协作精神。
寻找规律,并能用语言表达。训练学生的科学方法,培养学生的科学态度,养成科学探究的一般理念,实现学生的学习方式由被动接受式学习向主动探究性学习的根本转变。
检查学生是否能灵活应用以上知识解决问题。
答题的严谨性反映思维的全面性。 | ||||||||||||
课 堂 测 评
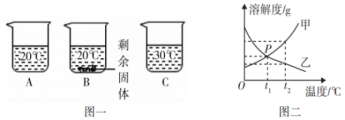
| 课堂评价:学生自主独立练习。 向装有等质量水的A、B、C烧杯中分别加入10 g、25 g、25 g NaNO3固体,充分溶解后,现象如图一所示。 (1)烧杯中的溶液一定属于饱和溶液的是____。 (2)图二中能表示NaNO3溶解度曲线的是______(选填“甲” 或“乙”)。 (3)由图二分析,若分别将100 g甲、乙的饱和溶液从t2 降温到t1℃,对所得溶液的叙述正确的_____选填序号)。 ①甲、乙都是饱和溶液 ②所含溶剂质量:甲<乙 ③溶液质量:甲>乙 ④溶质的质量分数:甲>乙
| 检测主干知识的熟练成程及准确率。 | |||||||||||||
教
学
反
思
| 打破原有复习课模式,整合教学内容,优化教学环节,不是简单的“旧事重提”而是“推陈出新”,充分调动了学生化学学习积极性,将枯燥抽象的理论复习转化为有趣的主线教学,在轻松愉悦的氛围中使学生不仅巩固了相关知识点,而且掌握了一定的学习方法及解决实际问题的能力。 本节课也还有需要改进的地方。在点的移动与溶液转化的关系环节,学生动得不够,究其原因是师生一起小心求证时设置了溶解度曲线上点与溶液状态的关系是怎样的问题,一步一步地为学生搭好了梯子,致使学生缺少思维的过程,缺少了交流和讨论。所以我们授人以渔还要授人以渔场。 | ||||||||||||||
《溶液》复习课学卷
一、根据溶液的形成填写下表。(尽量用化学用语填写)
溶液 | 溶质 | 溶剂 | 溶解时吸热或放热 | 溶液中存在的微粒 |
氢氧化钠溶液 |
|
|
|
|
硝酸钾溶液 |
|
|
|
|
蔗糖溶液 |
|
|
|
|
二、根据给出的氢氧化钠溶解度表,画出氢氧化钠溶解度曲线。
温度∕°C | 0 | 10 | 20 | 30 | 40 |
溶解度∕g | 42 | 51 | 109 | 119 | 129 |
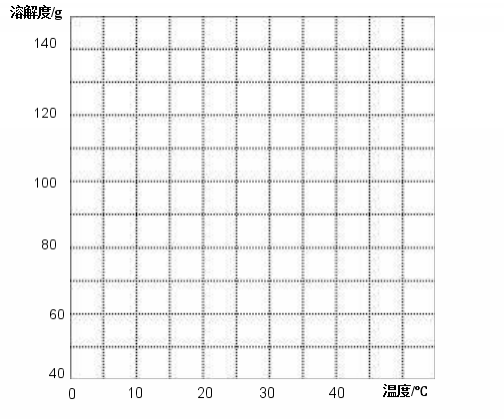
三、点的移动对溶质质量分数的影响
1.向上述氢氧化钠溶液(5g氢氧化钠溶解在50ml蒸馏水中)继续加溶质氢氧化钠,A点怎么移动?溶液中溶质的质量分数怎么变?
2.加热上述氢氧化钠溶液(5g氢氧化钠溶解在50ml蒸馏水中) ,A点怎么移动?溶液中溶质的质量分数怎么变?
3.比较A、B二点溶液中溶质的质量分数谁大谁小?
4.分组计算:①20 ℃时,100g水中溶解109g氢氧化钠达到饱和时溶液中溶质的质量分数。
② 20 ℃时,200g水中溶解218g氢氧化钠达到饱和时溶液中溶质的质量分数。
③ 20 ℃时,300g水中溶解327g氢氧化钠达到饱和时溶液中溶质的质量分数。
四、自我挑战
(2017·龙东)如图是a、b、c三种物质的溶解度曲线。据图回答下列问题:
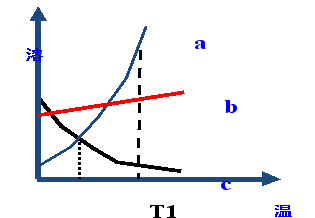
t2℃时,将a、b、c 三种物质的饱和溶液降温到t1℃,三种溶液中溶质的质量分数由大到小的顺序为_______。
五、巩固练习
(2017·梅州市)向装有等质量水的A、B、C烧杯中分别加入10 g、25 g、25 g NaNO3固体,充分溶解后,现象如图一所示。
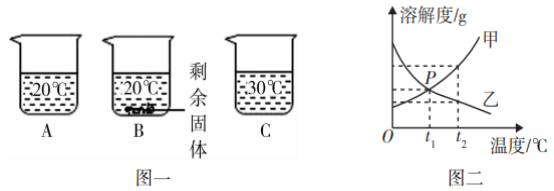 (1)烧杯中的溶液一定属于饱和溶液的是____。
(1)烧杯中的溶液一定属于饱和溶液的是____。
(2)图二中能表示NaNO3溶解度曲线的是______(选填“甲” 或“乙”)。
(3)由图二分析,若分别将100 g甲、乙的饱和溶液从t2 ℃降温到t1 ℃,对所得溶液的叙述正确的_______(选填序号)。
①甲、乙都是饱和溶液 ②所含溶剂质量:甲<乙 ③溶液质量:甲>乙 ④溶质的质量分数:甲>乙
1