必修2第一章第一节 元素周期表
第3课时 核素
学习目标
1.在复习原子结构的基础上,了解元素、核素、同位素的概念及其之间的关系。
2.掌握原子的构成,会用质量数表示原子的组成(AZX)。了解构成原子的粒子之间的数目关系,会根据数目关系进行有关计算。
阅读思考填写
【知识回顾】
1.原子的构成:原子是由居于原子中心的带正电的 和核外带负电的 构成的。原子由 和 构成。小结如下:
2.元素是具有 的一类原子的总称。
【阅读填写】
一、质量数
1.定义:原子的质量主要集中在 原子核 ,质子和中子的相对质量都近似为 ,如果忽略 的质量,将核内所有 取 值相加起来,所得的数值叫做质量数。符号: 。
2.计算式:质量数(A)= 质子数(Z) + 中子数(N)
3.应用:用质量数表示某种原子 ![]() X 。
X 。
二、核素和同位素
1.核素:具有一定数目 和一定数目 的一种原子称为核素。
2.同位素: 相同而 不同的 的不同原子互称同位素。(即 的 互称为同位素。)
3.氢元素有 三种核素;氧元素有 三种核素;
碳元素有 三种核素;铀元素有 等多种核素。
考古是利用 146C 测定一些文物的年代,氘(21H)、氚(31H) 用于制造氢弹。
(参考答案)【知识回顾】1.原子核 电子 。质子 中子 2.相同核电荷数 。
【阅读填写】一、1. 1 ,核外电子, 质子和中子的相对质量 近似整数 。 A
2.质量数(A)= 质子数(Z) + 中子数(N)
二、1. 质子 中子 。2. 质子数 中子数 同一元素 。(同一元素 不同的核素 。)
3. 氕(11H)、氘(21H)、氚(31H) ; 168O、178O、 188O、 ; 126C、 136C、 146C ;23492U、23592U、23892U、等多种核素。 146C ,氘(21H)、氚(31H) 。
自主(合作)探究
三、核素
〖探究1〗构成原子的粒子及其性质
构成原子的粒子 | 电 子 | 质 子 | 中 子 |
电性和电量 | 1个电子带1个单位负电荷 | 1个质子带1个单位正电荷 | 不显电性 |
质量/kg | 9.109×10-31 | 1.673×10-27 | 1.675×10-27 |
相对质量 | 1/1836(电子与质子质量之比) | 1.007 | 1.008 |
思考:从表格得出原子的质量主要取决于哪种微粒?质子带正电,电子带负电,而原子不显电性的原因是什么?从中可以得到什么关系?
〖归纳1〗
1.质量数 质量数(A)= +
在化学上,我们为了方便地表示某一原子,在元素符号的左下角标出其质子数,左上角标出质量数: ![]() X。请填写下列表格:
X。请填写下列表格:
氢元素的原子核 | 原子名称 | 原子符号( | |
质子数(Z) | 中子数(N) | ||
|
| 氕 |
|
|
| 氘 |
|
|
| 氚 |
|
〖探究2〗
1.填写下表,总结原子质量数(A)与相对原子质量的关系。
原子 | 质子数 (Z) | 中子数 (N) | 质量数 (A) | 相对原子质量 |
F | 9 | 10 |
| 18.998 |
Na | 11 | 12 |
| 22.990 |
2.请完成下表并思考:原子形成离子之后构成原子的微粒哪些发生了变化?如何改变?质量数呢?从中你能不能得出质子数、中子数、质量数和电子数之间的数目关系呢?
符号 | 质子数 | 中子数 | 质量数 | 电子数 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
〖例1〗某元素X天然存在的一个原子中共有质子、中子、电子共93个,其中35个粒子不带电,则X元素的该原子的相对原子质量约为( )
A.35 B.30 C.64 D.58
〖例2〗 Rn–离子有 m 个电子,它的质量数为 A,则原子核内的中子数
为 ,a克HnR 中所含中子的物质的量是 。
〖思考1〗
1.截止到1999年,人们已经发现了113种元素,是否可以说我们已经发现了113种原子呢?为什么?举例说明。
2.完成下表。
元素符号 | 原子符号 | 核电荷数 | 中子数 | 电子数 |
|
| 1 | 0 | 1 |
| 1 | 1 | 1 | |
| 1 | 2 | 1 | |
|
| 6 | 6 | 6 |
|
|
|
| |
| 6 | 8 | 6 |
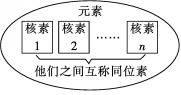
3.元素、核素、同位素三者之间的关系你能不能用一个图示说明呢?如何理解同位素概念中“同位”的含义?
〖归纳2〗
2.元素、核素、同位素
(1)元素: 。
核素: 。
同位素: 。
(2)核素的种类由 决定,元素的种类由 决定。
〖说明〗
(1)绝大多数元素都包括多种核素,如H、O等;也有的天然元素仅含一种核素,如Na、F等。
(2)同位素的特性: a、同位素的化学性质相同,物理性质不同。
b、天然存在的某种元素中,不论是游离态还是化合态,各种同位素所占的原子个数百分比(即丰度)一般是不变的。
(参考答案)〖探究1〗原子的质量主要取决于质子数和中子数;每个质子带一个单位正电荷,每个核外电子带一个单位负电荷,中子不带电荷,而组成每个原子的质子数和核外电子数相等,故原子不显电性;质子数 = 核外电子数。质量数(A)= 质子数(Z) + 中子数(N);
(填表)氢元素的三种原子核从上到下质子数(Z)1、1、1;中子数(N)0、1、2.
〖探究2〗1. (填表)19、23;原子的质量数等于相对原子质量的近似整数值。
18 | 22 | 40 | 18 |
11 | 12 | 23 | 10 |
12 | 12 | 24 | 12 |
17 | 18 | 35 | 18 |
2.(填表)
原子形成离子之后质子数、中子数、质量数均不变,电子数则会变。阳离子的电子数=质子数-离子所带电荷数;
阴离子的电子数=质子数+离子所带电荷数。
〖例1〗35为中子数,质子数和电子数共有93-35=58,质子数=电子数=58/2=29,质量数=质子数+中子数=29+35=64.答案为C
〖例2〗 Rn–离子有 m 个电子,则R 原子的电子数(即质子数)为m-n,中子数=质量数-质子数=A-(m-n)= A-m+n ;a克HnR 物质的量为a/((n+A)摩,而 1个HnR所含中子数为1个R原子所含中子数(H原子中子数为0),故a克HnR所含中子的物质的量为a/((n+A)摩×(A-m+n)
=a(A-m+n)/(n+A)
〖思考1〗1.不能,原子种类数远远超过113种。因为绝大多数元素都包括多种核素,同位素是一个普遍现象。举例略。
H |
|
|
|
|
|
|
|
| |
|
|
|
| |
C |
|
|
|
|
| 6 | 7 | 6 | |
|
|
|
|
2.
3.
〖归纳2〗1.(略)2.质子数和中子数, 质子数
〖课堂检测〗
1.有以下一些微粒:①![]() ②
②![]() ③
③![]() ④
④![]() ⑤
⑤![]()
其中互为同位素的是 和 ;质量数相等但不能互为同位素的是 和
中子数相等,但质子数不等的是 和 。
2.下列各组中属于同位素的是( )
A.40K与40Ca B.T2O和H2O C.40K与39K D.金刚石与石墨
3.下列叙述中正确的是( )
A.目前已发现113种元素,即已发现113种原子
B.核外电子总数不同的原子,可能是同种元素的原子
C.同一元素的各种同位素的化学性质基本相同
D.任何元素的原子都是由核外电子和核内中子、质子组成的
4.下列说法正确的是( )
①氘和氚是质量数不同、质子数相同的氢的两种同位素;②氢元素是指![]() H;③
H;③![]() H、
H、![]() H、
H、![]() H是氢的三种同位素,是同一元素的三种原子;④
H是氢的三种同位素,是同一元素的三种原子;④![]() H和
H和![]() H的化学性质几乎完全相同。
H的化学性质几乎完全相同。
A.②③B.③④ C.①③④ D.②③④
5.某元素二价阳离子核外有18个电子,质量数为42,该元素原子的原子核中的中子数为( )
A. 18B.20C. 22D.16
6.我国的纳米基础研究能力已跻身于世界前列,例如曾作为我国两年前十大科技成果之一的就是一种合成纳米材料,化学式为RN。已知该化合物中的R3+核外有28个电子。则R元素位于元素周期表的( )
A.第3周期ⅤA族 B.第4周期ⅢA族 C.第5周期ⅢA族 D.第4周期ⅤA族
(参考答案) 1. ① ④ ;③ ⑤;② ③。2.C 3.D 4.C 5.C 6.B
〖归纳小结第一节并完成课本习题〗